Hepatozoonosis canina: resumen bibliográfico
 Hepatozoonosis canina es una enfermedad emergente, causada por especies de protozoos Hepatozoon que pertenecen al Phylum Apicomplexa, Clase Sporozoea, Orden Eucoccidia, Familia Haemogragarinidae, Género Hepatozoon. Existen más de 300 especies de Hepatozoon que infectan a diferentes mamíferos, aves, reptiles y anfibios, al menos 46 se encontraron en mamíferos. H. canis se descubrió por primera vez en India en 1905 y desde entonces se ha difundido por muchos países del mundo. Este parásito se disemina entre los huéspedes intermediarios vertebrados a través de invertebrados hematófagos que son huéspedes definitivos y simultáneamente vectores, los caninos se infectan a través de la ingestión de las mismas conteniendo esporozoítos infectivos. Dos diferentes especies de Hepatozoon infectan a caninos: H.canis y H. americanum, habitan dentro de los leucocitos
Hepatozoonosis canina es una enfermedad emergente, causada por especies de protozoos Hepatozoon que pertenecen al Phylum Apicomplexa, Clase Sporozoea, Orden Eucoccidia, Familia Haemogragarinidae, Género Hepatozoon. Existen más de 300 especies de Hepatozoon que infectan a diferentes mamíferos, aves, reptiles y anfibios, al menos 46 se encontraron en mamíferos. H. canis se descubrió por primera vez en India en 1905 y desde entonces se ha difundido por muchos países del mundo. Este parásito se disemina entre los huéspedes intermediarios vertebrados a través de invertebrados hematófagos que son huéspedes definitivos y simultáneamente vectores, los caninos se infectan a través de la ingestión de las mismas conteniendo esporozoítos infectivos. Dos diferentes especies de Hepatozoon infectan a caninos: H.canis y H. americanum, habitan dentro de los leucocitos
Epidemiología
Hepatozoonosis canina está distribuida, estrechamente relacionada a la presencia del vector Rhipicephalus sanguineus, en Africa, sur de Europa, América y Asia, además Amblyomma maculatum es el vector de H. americanum en Norteamérica y puede ser el vector de H. canis. Afectan a caninos domésticos; varias especies morfológicamente similares se han encontrado en otros carnívoros como zorro, chacal, perro salvaje africano, hiena, guepardo, leopardo y león. En cachorros ha sido reportada la transmisión vertical. No presenta predilección por sexo, raza o edad.
Etiología, transmisión y patogenia
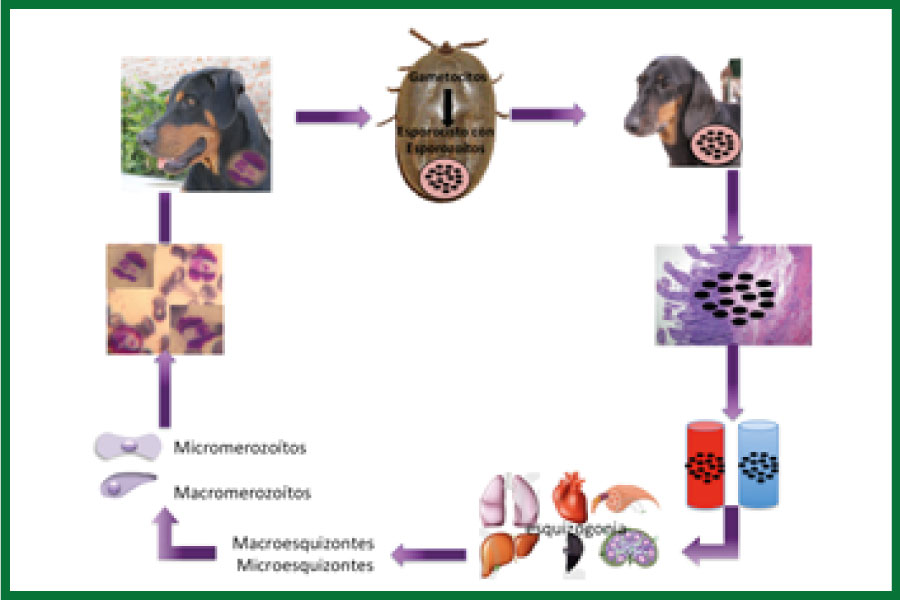
Hepatozoon en el estadío de gametocito se halla dentro de neutrófilos y monocitos, al alimentarse de la sangre de un animal con parasitemia, las garrapatas ingieren neutrófilos y monocitos infectados. Luego, los microorganismos se replican y evolucionan hasta llegar a esporozoítos en el hemocele; los caninos ingieren la garrapata infectada, dentro del animal los esporozoítos penetran la pared intestinal y son transportados por sangre o linfa hasta los fagocitos mononucleares o células endoteliales, donde la esquizogonia da lugar al desarrollo de macroesquizontes. Los macromerozoítos liberados penetran en células de músculo esquelético, miocardio, pulmones, bazo, linfoglándulas e hígado, donde se desarrollan nuevos ciclos de esquizogonia, que resultan en la formación de microesquizontes. En este estadío, los parásitos pueden persistir en las células como estructuras quísticas durante un tiempo variable sin inducir respuesta inflamatoria alguna. Sin embargo, cuando los micromerozoítos se liberan ocurre una respuesta inflamatoria granulomatosa que produce dolor, la replicación alrededor de los huesos provoca una marcada reacción perióstica. Los neutrófilos y monocitos se infectan al fagocitar los micromerozoítos o al ser penetrados directamente por ellos. Una vez dentro, evolucionan a gametocitos y el ciclo vuelve a iniciarse cuando una garrapata ingiere los leucocitos infectados. (Figura 1)
El período de incubación es de dos a cuatro semanas. El desarrollo de hepatozoonosis está asociado con el estado inmunitario del animal, viéndose asociada muchas veces a Toxoplasma gondii, Babesia canis., Leishmania sp, Ehrlichia sp, Parvovirus, Distemper y defectos genéticos de los neutrófilos.
La inmunidad humoral es estimulada por H. canis y los anticuerpos formados pueden favorecer los depósitos amiloides e inmunocomplejos en múltiples órganos produciendo vasculitis, glomerulonefritis y otros trastornos inmunomediados.
Signos clínicos
La enfermedad puede ser:
– Asintomática a leve: cuando menos del 5% de los neutrófilos se ven afectados, produciendo anemia y leve trombocitopenia
– Grave: cuando un alto porcentaje de los neutrófilos están afectados, se caracteriza por miositis crónica y mialgia con trastornos de locomoción, debilidad y muerte, además de hipertermia, letargia, pérdida de peso, descarga oculonasal, linfoadenomegalia, proliferación del periostio en columna vertebral, costillas y extremidades, rigidez cervical y parálisis lumbar.
Diagnóstico
– Frotis sanguíneo: Se debe examinar en forma detallada, pues en infecciones crónicas el porcentaje de neutrófilos y/o monocitos parasitados es muy bajo. En el caso de H. americanum son infrecuentes los gametocitos intraleucocitarios y son frecuentes los merontes intramusculares, al contrario de H. canis donde son frecuentes los gametocitos intraleucocitarios y no se han reportado merontes intramusculares. El frotis se colorea con Wright, Giemsa o tinción 15, se observan los gametocitos de color azul brillante, de forma alargada, rectangulares que miden de 8 a 12 ?m de largo por 3 a 6 ?m de ancho.
– Hemograma: se observa anemia normocítica, normocrómica y ocasionalmente regenerativa, recuento de leucocitos normal en casos de parasitemia baja y elevado con neutrofilia con desviación a la izquierda y eosinofilia en casos de parasitemia alta. Ocasionalmente se presenta trombocitopenia
– Química sanguínea: podemos observar hiperproteinemia (hiperglobulinemia e hipoalbuminemia) y aumento de creatinin-quinasa, FAS, LDH y AST (GOT)
– Patología: Citología por punción por aguja fina de ganglio e Histopatología de biopsia muscular o hepática donde se observan quistes con microesquizontes en desarrollo, de aproximadamente 250-500 mm de diámetro, en el caso de ruptura de los mismos se presenta reacción piogranulomatosa. En hueso se observa exostosis periosteal, fibrosis intratrabecular e incremento de actividad osteoblástica y osteoclástica. En médula ósea hiperplasia granulocítica con aumento de relación mieloide-eritroide.
– Rayos X: pueden observarse cambios en las radiografías por alteraciones del periostio como consecuencia de la inflamación muscular en la zona de inserción
– Serología: No se realizan pruebas serológicas diagnósticas en nuestro país. Los anticuerpos reactivos contra los gametocitos de H. canis pueden detectarse mediante inmunofluorescencia indirecta a partir de los 16 a 39 días post-infección (IgM) y 22 a 43 días post- infección (IgG). También se ha estudiado con pruebas de reacción en cadena de polimerasa (PCR), Western inmunoblotting, ELISA y fijación de complemento
Tratamiento y control
No se conoce hasta el momento un tratamiento 100 % eficaz contra la hepatozoonosis canina. Se han utilizado con respuesta muy variada:
Toltrazuril: 5-10mg/kg, SC/PO, cada 24 horas durante 5días, realizar control de frotis sanguíneo, en el caso de dar positivo repetir el esquema.
Imidocarb: 5mg/kg, SC, en dosis única o a los 14 días
Trimetoprim-Sulfonamidas: 15 mg/kg cada 12 horas
Glucocorticoides: efecto antiinflamatorio y supresor de respuesta inmunomediada, administrar por períodos cortos.
La mayoría de los perros experimentan recaídas algunos meses después del tratamiento. La respuesta a la segunda terapia suele ser menor que a la primera. Se debe realizar el control de las garrapatas para evitar la diseminación de la enfermedad.
Bibliografía
Ardila,A.M.; Cala, F. A.; Vargas, G.; Arcila, V.; Castellanos,V. Reporte de casos clínicos con Hepatozoon canis en el Centro Médico Quirúrgico Veterinario de la Universidad Cooperativa de Colombia. REDVET. Revista electrónica de Veterinaria 1695-7504 2007 Volumen VIII Número 5.
Baneth, G.; Aroch, I. Y Presentey, B Hepatozoon canis infection in litter of Dalmatian dogs, Vet parasitol, Jun., 1997. v. 70, no 1-3, Pp. 201-206.
Baneth G, Shkap V, Presentey Bz, Pipano E. Hepatozoon canis: The prevalence of antibodies and gametocytes in dogs in Israel. Vet. Res. Communica- tions 20(1):41-46, 1996.
Baneth G, Aroch I, Tal N, Harrus S. Hepatozoon species infection in domestic cats: A retrospec- tive study. Vet. Parasitol. 79: 123-133, 1998.
Baneth G. Canine and feline hepatozoonosis. More than one disease. Proceedings of the Small World Animal Vet.Association. Sidney. Australia. 2007
Craig, T. M.; Smallwood, J. E.; Knauer, K. W.; Mcgrath, J. P.Hepatozoon canis infection in dogs: clinical, radiographic, and hematologic findings, , J Am Vet Med Assoc, Oct., 1988. v. 173, no 8, Pp. 967-972
Ettinger, S.J.;Fieldman, E. C. Tratado de medicina interna veterinaria, Enfermedades del perro y gato, 5ta Ed.., Buenos Aires, Argentina, Editorial Inter-Médica, XXI-2002. v. I y II, pp. 458 y 2055.
Ewing,S. A.; Panciera, R. J. American Canine Hepatozoonosis. Department of Pathobiology, College of Veterinary Medicine, Oklahoma State University, Stillwater, Oklahoma Clinical Microbiology Reviews, Oct. 2003, Vol. 16, No. 4. American Society for Microbiology.
Giannitti, F.; Diab, S.; Uzal, F.; Fresneda, K.; Rossi, D.; Talmi-Frank, D.; Baneth,G.Infection with a Hepatozoon sp. closely related to Hepatozoon felis in a wild Pampas grayfox (Lycalopex – Pseudalopex – gymnocercus) co-infected with canine distemper virus. Veterinary Parasitology 186 (2012) 497–502
Ivanov, A; Tsachev, I. Hepatozoon Canis And Hepatozoonosis In The Dog. Faculty of Veterinary Medicine, Trakia University, Stara Zagora, Bulgaria Trakia Journal of Sciences, Vol. 6, No. 2, pp27-35, 2008
Kujman, S.; Sepiurka, L.; Greco, S. Hemoparásitos Transmitidos Por Garrapatas. 1º Parte. Introducción Teórica. Universidad Del Centro Prov. Buenos Aires (Tandil) Argentina. Facultad Ciencias Veterinarias. Área De Clínica Médica Y Quirúrgica De Pequeños Animales
Moreno, B.A.; Fernández, J.L.; Rodríguez, J.H. Y Chacón-M. De Lara G.-Ripoll, F.R., Hepatozoonosis canina., Rev. AMMVEPE, Nov./Dic., 2001.